Cada elemento está designado por su símbolo químico (como H, N, O, C y Na) y posee propiedades únicas. Estas propiedades únicas permiten que los elementos se combinen y se unan entre sí de maneras específicas.
Átomos
Un átomo es el componente más pequeño de un elemento que retiene todas las propiedades químicas de ese elemento. Por ejemplo, un átomo de hidrógeno tiene todas las propiedades del elemento hidrógeno, tal como existe como un gas a temperatura ambiente, y se une con oxígeno para crear una molécula de agua. Los átomos de hidrógeno no se pueden descomponer en algo más pequeño mientras se conservan las propiedades del hidrógeno. Si un átomo de hidrógeno se descompusiera en partículas subatómicas, ya no tendría las propiedades del hidrógeno.
En el nivel más básico, todos los organismos están formados por una combinación de elementos. Contienen átomos que se combinan para formar moléculas. En los organismos multicelulares, como los animales, las moléculas pueden interactuar para formar células que se combinan para formar tejidos, que forman órganos. Estas combinaciones continúan hasta que se forman organismos multicelulares completos.
Todos los átomos contienen protones, electrones y neutrones. La única excepción es el hidrógeno (H), que está formado por un protón y un electrón. Un protón es una partícula cargada positivamente que reside en el núcleo (el núcleo del átomo) de un átomo y tiene una masa de 1 y una carga de +1. Un electrón es una partícula cargada negativamente que viaja en el espacio alrededor del núcleo. En otras palabras, reside fuera del núcleo. Tiene una masa insignificante y tiene una carga de -1.
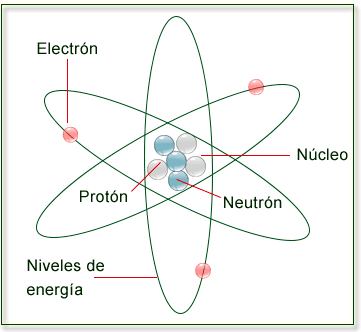 |
| Los átomos están formados por protones y neutrones ubicados dentro del núcleo y electrones que lo rodean. |
Los neutrones, como los protones, residen en el núcleo de un átomo. Tienen una masa de 1 y sin cargo. Las cargas positivas (protones) y negativas (electrones) se equilibran entre sí en un átomo neutro, que tiene una carga neta cero.
Como los protones y los neutrones tienen cada uno una masa de 1, la masa de un átomo es igual al número de protones y neutrones de ese átomo. El número de electrones no tiene en cuenta la masa total, porque su masa es muy pequeña.
Como se indicó anteriormente, cada elemento tiene sus propias propiedades únicas. Cada uno contiene un número diferente de protones y neutrones, dándole su propio número atómico y número de masa. El número atómico de un elemento es igual al número de protones que contiene ese elemento. El número de masa, o masa atómica, es el número de protones más el número de neutrones de ese elemento. Por lo tanto, es posible determinar el número de neutrones restando el número atómico del número de masa.
Estos números proporcionan información sobre los elementos y cómo reaccionarán cuando se combinen. Los diferentes elementos tienen diferentes puntos de fusión y ebullición, y están en diferentes estados (líquido, sólido o gaseoso) a temperatura ambiente. También se combinan de diferentes maneras. Algunos forman tipos específicos de enlaces, mientras que otros no. La forma en que se combinan se basa en la cantidad de electrones presentes. Debido a estas características, los elementos se organizan en la tabla periódica de elementos, una tabla de los elementos que incluye el número atómico y la masa atómica relativa de cada elemento. La tabla periódica también proporciona información clave sobre las propiedades de los elementos (Figura 2.2), a menudo indicada por codificación de colores. La disposición de la tabla también muestra cómo están organizados los electrones en cada elemento y proporciona detalles importantes sobre cómo reaccionarán los átomos entre sí para formar moléculas.
Los isótopos son formas diferentes del mismo elemento que tienen el mismo número de protones, pero un número diferente de neutrones. Algunos elementos, como el carbono, el potasio y el uranio, tienen isótopos naturales. El carbono 12, el isótopo más común del carbono, contiene seis protones y seis neutrones. Por lo tanto, tiene un número de masa de 12 (seis protones y seis neutrones) y un número atómico de 6 (lo que lo convierte en carbono). El carbono 14 contiene seis protones y ocho neutrones. Por lo tanto, tiene un número de masa de 14 (seis protones y ocho neutrones) y un número atómico de 6, lo que significa que sigue siendo el elemento carbono. Estas dos formas alternativas de carbono son los isótopos. Algunos isótopos son inestables y perderán protones, otras partículas subatómicas o energía para formar elementos más estables. Estos se llaman isótopos radiactivos o radioisótopos.
CONEXIÓN DE EVOLUCIÓN: Datación por carbono
El carbono 14 (14C) es un radioisótopo natural
que se crea en la atmósfera por los rayos cósmicos. Este es un proceso
continuo, por lo que siempre se está creando más 14C. A medida que
se desarrolla un organismo vivo, el nivel relativo de 14C en su
cuerpo es igual a la concentración de 14C en la atmósfera. Cuando un
organismo muere, ya no ingiere 14C, por lo que la relación
disminuirá. El 14C se desintegra a 14N mediante un
proceso llamado desintegración beta; emite energía en este lento proceso.
Después de aproximadamente 5,730 años, solo la mitad de la
concentración inicial de 14C se habrá convertido a 14N.
El tiempo que tarda la mitad de la concentración original de un isótopo en
decaer a su forma más estable se llama vida media. Debido a que la vida media
del 14C es larga, se usa para envejecer objetos que antes vivían,
como los fósiles. Usando la proporción de la concentración de 14C
encontrada en un objeto a la cantidad de 14C detectada en la
atmósfera, se puede determinar la cantidad del isótopo que aún no se ha
descompuesto. Sobre la base de esta cantidad, la edad del fósil se puede
calcular a unos 50,000 años. Los isótopos con vidas medias más largas, como el
potasio 40, se utilizan para calcular las edades de los fósiles más antiguos. Mediante
el uso de la datación por carbono, los científicos pueden reconstruir la
ecología y la biogeografía de los organismos que vivieron en los últimos 50,000
años.
| La edad de los restos que contienen carbono y tienen menos de aproximadamente 50,000 años, como este mamut pigmeo, se puede determinar utilizando la datación por carbono. |
Enlaces químicos
La forma en que los elementos interactúan entre sí depende de cómo están dispuestos sus electrones y cuántas aberturas para electrones existen en la región más externa donde los electrones están presentes en un átomo. Los electrones existen a niveles de energía que forman capas alrededor del núcleo. La capa más cercana puede contener hasta dos electrones. La capa más cercana al núcleo siempre se llena primero, antes de que se pueda llenar cualquier otra capa. El hidrógeno tiene un electrón; por lo tanto, solo tiene un lugar ocupado dentro del caparazón más bajo. El helio tiene dos electrones; por lo tanto, puede llenar completamente la capa más baja con sus dos electrones. Si observa la tabla periódica, verá que el hidrógeno y el helio son los únicos dos elementos en la primera fila. Esto se debe a que solo tienen electrones en su primera capa. El hidrógeno y el helio son los dos únicos elementos que tienen la capa más baja y ninguna otra capa.
El segundo y tercer nivel de energía pueden contener hasta ocho electrones. Los ocho electrones están dispuestos en cuatro pares y una posición en cada par se llena con un electrón antes de completar cualquier par.
Al mirar de nuevo la tabla periódica, notará que hay siete filas. Estas filas corresponden al número de shells que tienen los elementos dentro de esa fila. Los elementos dentro de una fila particular tienen un número creciente de electrones a medida que las columnas avanzan de izquierda a derecha. Aunque cada elemento tiene el mismo número de capas, no todas las capas están completamente llenas de electrones. Si observa la segunda fila de la tabla periódica, encontrará litio (Li), berilio (Be), boro (B), carbono (C), nitrógeno (N), oxígeno (O), flúor (F), y neón (Ne). Todos estos tienen electrones que ocupan solo las capas primera y segunda. El litio tiene solo un electrón en su capa más externa, el berilio tiene dos electrones, el boro tiene tres, y así sucesivamente, hasta que la capa completa se llena con ocho electrones, como es el caso del neón.
No todos los elementos tienen suficientes electrones para llenar sus capas más externas, pero un átomo es más estable cuando se llenan todas las posiciones de electrones en la capa más externa. Debido a estas vacantes en las capas más externas, vemos la formación de enlaces químicos o interacciones entre dos o más elementos iguales o diferentes que resultan en la formación de moléculas. Para lograr una mayor estabilidad, los átomos tenderán a llenar completamente sus capas externas y se unirán con otros elementos para lograr este objetivo al compartir electrones, aceptar electrones de otro átomo o donar electrones a otro átomo. Debido a que las capas más externas de los elementos con números atómicos bajos (hasta calcio, con número atómico 20) pueden contener ocho electrones, esto se conoce como la regla del octeto. Un elemento puede donar, aceptar o compartir electrones con otros elementos para llenar su capa externa y satisfacer la regla del octeto.
Cuando un átomo no contiene el mismo número de protones y electrones, se llama ion. Debido a que el número de electrones no es igual al número de protones, cada ion tiene una carga neta. Los iones positivos se forman al perder electrones y se denominan cationes. Los iones negativos se forman al ganar electrones y se denominan aniones.
Por ejemplo, el sodio solo tiene un electrón en su capa más externa. Se necesita menos energía para que el sodio done ese electrón que para aceptar siete electrones más para llenar la capa externa. Si el sodio pierde un electrón, ahora tiene 11 protones y solo 10 electrones, dejándolo con una carga general de +1. Ahora se llama ion de sodio.
El átomo de cloro tiene siete electrones en su capa externa. Una vez más, es más eficiente energéticamente que el cloro gane un electrón que pierda siete. Por lo tanto, tiende a ganar un electrón para crear un ion con 17 protones y 18 electrones, lo que le da una carga neta negativa (–1). Ahora se llama ión cloruro. Este movimiento de electrones de un elemento a otro se conoce como transferencia de electrones. Como en la imagen siguiente, un átomo de sodio (Na) solo tiene un electrón en su capa más externa, mientras que un átomo de cloro (Cl) tiene siete electrones en su capa más externa. Un átomo de sodio donará su único electrón para vaciar su caparazón, y un átomo de cloro aceptará ese electrón para llenar su caparazón, convirtiéndose en cloruro. Ambos iones ahora satisfacen la regla del octeto y tienen capas externas más completas. Debido a que el número de electrones ya no es igual al número de protones, cada uno es ahora un ion y tiene una carga +1 (sodio) o –1 (cloruro).
| Los elementos tienden a llenar sus capas más externas con electrones. Para hacer esto, pueden donar o aceptar electrones de otros elementos. |
Enlaces iónicos
Hay cuatro tipos de enlaces o interacciones: iones,
covalentes, enlaces de hidrógeno e interacciones de van der Waals. Los enlaces
iónicos y covalentes son interacciones fuertes que requieren una mayor entrada
de energía para separarse. Cuando un elemento dona un electrón de su capa
externa, como en el ejemplo del átomo de sodio anterior, se forma un ion
positivo. El elemento que acepta el electrón ahora está cargado negativamente.
Debido a que las cargas positivas y negativas se atraen, estos iones permanecen
juntos y forman un enlace iónico, o un enlace entre iones. Los elementos se
unen con el electrón de un elemento que permanece predominantemente con el otro
elemento. Cuando los iones Na+ y Cl– se combinan para
producir NaCl, un electrón de un átomo de sodio permanece con los otros siete
del átomo de cloro, y los iones de sodio y cloruro se atraen entre sí en una
red de iones con una carga neta cero.
Bonos Covalentes
Otro tipo de enlace químico fuerte entre dos o más átomos es
un enlace covalente. Estos enlaces se forman cuando un electrón se comparte
entre dos elementos y son la forma más fuerte y más común de enlace químico en
los organismos vivos. Se forman enlaces covalentes entre los elementos que
forman las moléculas biológicas en nuestras células. A diferencia de los
enlaces iónicos, los enlaces covalentes no se disocian en el agua.
Los átomos de hidrógeno y oxígeno que se combinan para
formar moléculas de agua están unidos por enlaces covalentes. El electrón del
átomo de hidrógeno divide su tiempo entre la capa externa del átomo de
hidrógeno y la capa externa incompleta del átomo de oxígeno. Para llenar
completamente la capa externa de un átomo de oxígeno, se necesitan dos
electrones de dos átomos de hidrógeno, de ahí el subíndice "2" en H2O.
Los electrones se comparten entre los átomos, dividiendo su tiempo entre ellos
para "llenar" la capa externa de cada uno. Este intercambio es un
estado de energía más bajo para todos los átomos involucrados que si existieran
sin sus capas exteriores llenas.
Hay dos tipos de enlaces covalentes: polares y no polares.
Los enlaces covalentes no polares se forman entre dos átomos del mismo elemento
o entre diferentes elementos que comparten los electrones por igual. Por
ejemplo, un átomo de oxígeno puede unirse con otro átomo de oxígeno para llenar
sus capas exteriores. Esta asociación no es polar porque los electrones se
distribuirán por igual entre cada átomo de oxígeno. Se forman dos enlaces
covalentes entre los dos átomos de oxígeno porque el oxígeno requiere dos
electrones compartidos para llenar su capa más externa. Los átomos de nitrógeno
formarán tres enlaces covalentes (también llamados triples covalentes) entre
dos átomos de nitrógeno porque cada átomo de nitrógeno necesita tres electrones
para llenar su capa más externa. Otro ejemplo de un enlace covalente no polar
se encuentra en la molécula de metano (CH4). El átomo de carbono
tiene cuatro electrones en su capa más externa y necesita cuatro más para
llenarlo. Obtiene estos cuatro de cuatro átomos de hidrógeno, cada átomo
proporciona uno. Todos estos elementos comparten los electrones por igual,
creando cuatro enlaces covalentes no polares.
 |
| La molécula de agua representa un enlace polar con una carga ligeramente positiva en los átomos de hidrógeno y una carga ligeramente negativa en el oxígeno. Un ejemplo de enlace no polar es metano. |
Enlaces de hidrógeno
Los enlaces iónicos y covalentes son enlaces fuertes que requieren una energía considerable para romperse. Sin embargo, no todos los enlaces entre elementos son enlaces iónicos o covalentes. También se pueden formar enlaces más débiles. Estas son atracciones que ocurren entre cargas positivas y negativas que no requieren mucha energía para romperse. Dos enlaces débiles que ocurren con frecuencia son los enlaces de hidrógeno y las interacciones de van der Waals. Estos enlaces dan lugar a las propiedades únicas del agua y las estructuras únicas de ADN y proteínas.
Cuando se forman enlaces covalentes polares que contienen un átomo de hidrógeno, el átomo de hidrógeno en ese enlace tiene una carga ligeramente positiva. Esto se debe a que el electrón compartido es atraído más fuertemente hacia el otro elemento y lejos del núcleo de hidrógeno. Debido a que el átomo de hidrógeno es ligeramente positivo (δ +), se sentirá atraído por las cargas parciales negativas vecinas (δ–). Cuando esto sucede, se produce una interacción débil entre la carga δ + del átomo de hidrógeno de una molécula y la carga δ– de la otra molécula. Esta interacción se llama enlace de hidrógeno. Este tipo de enlace es común; Por ejemplo, la naturaleza líquida del agua es causada por los enlaces de hidrógeno entre las moléculas de agua. Los enlaces de hidrógeno le dan al agua las propiedades únicas que sostienen la vida. Si no fuera por la unión de hidrógeno, el agua sería un gas en lugar de un líquido a temperatura ambiente.
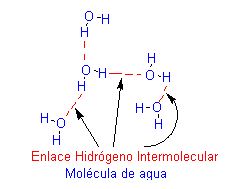 |
| Los enlaces de hidrógeno se forman entre cargas ligeramente positivas (δ +) y ligeramente negativas (δ–) de moléculas covalentes polares, como el agua. |
Se pueden formar enlaces de hidrógeno entre diferentes moléculas y no siempre tienen que incluir una molécula de agua. Los átomos de hidrógeno en enlaces polares dentro de cualquier molécula pueden formar enlaces con otras moléculas adyacentes. Por ejemplo, los enlaces de hidrógeno mantienen juntas dos largas cadenas de ADN para dar a la molécula de ADN su estructura característica de doble cadena. Los enlaces de hidrógeno también son responsables de parte de la estructura tridimensional de las proteínas.
Interacciones de van der Waals
Al igual que los enlaces de hidrógeno, las interacciones de van der Waals son atracciones débiles o interacciones entre moléculas. Ocurren entre átomos polares, unidos covalentemente, en diferentes moléculas. Algunas de estas atracciones débiles son causadas por cargas parciales temporales formadas cuando los electrones se mueven alrededor de un núcleo. Estas interacciones débiles entre las moléculas son importantes en los sistemas biológicos.
CONEXIÓN PROFESIONAL: Técnico de radiografía
¿Alguna vez, usted o alguien que conozca, se ha hecho una resonancia magnética (MRI), una mamografía o una radiografía? Estas pruebas producen imágenes de sus tejidos y órganos blandos (como con una resonancia magnética o mamografía) o sus huesos (como sucede en una radiografía) mediante ondas de radio o isótopos especiales (radiomarcados o fluorescentes) que se ingieren o inyectan en el cuerpo. Estas pruebas proporcionan datos para el diagnóstico de enfermedades al crear imágenes de sus órganos o sistema esquelético.
La resonancia magnética funciona sometiendo los núcleos de hidrógeno, que son abundantes en el agua en los tejidos blandos, a campos magnéticos fluctuantes, lo que hace que emitan su propio campo magnético. Esta señal es leída por los sensores en la máquina e interpretada por una computadora para formar una imagen detallada.
Algunos tecnólogos y técnicos de radiografía se especializan en tomografía computarizada, resonancia magnética y mamografía. Producen películas o imágenes del cuerpo que ayudan a los profesionales médicos a examinar y diagnosticar. Los radiólogos trabajan directamente con los pacientes, explicando la maquinaria, preparándolos para los exámenes y asegurando que su cuerpo o partes del cuerpo estén posicionados correctamente para producir las imágenes necesarias. Los médicos o radiólogos luego analizan los resultados de la prueba.
Los técnicos de radiografía pueden trabajar en hospitales, consultorios médicos o centros especializados de imágenes. La capacitación para convertirse en técnico de radiografía se lleva a cabo en hospitales, colegios y universidades que ofrecen certificados, títulos de asociado o licenciaturas en radiografía.
¿Te sirvió el contenido del tema? ¿tienes alguna duda o sugerencia?
Puedes escribir un comentario en la parte de abajo y nosotros con gusto te responderemos. Esperemos que tengas un lindo día. ¡Mucho éxito en tus estudios!
