El agua es polar
Los átomos de hidrógeno y oxígeno dentro de las moléculas de agua forman enlaces covalentes polares. Los electrones compartidos pasan más tiempo asociados con el átomo de oxígeno que con los átomos de hidrógeno. No existe una carga general para una molécula de agua, pero hay una ligera carga positiva en cada átomo de hidrógeno y una ligera carga negativa en el átomo de oxígeno. Debido a estas cargas, los átomos de hidrógeno ligeramente positivos se repelen entre sí y forman la forma única que se ve en la Figura 2.7. Cada molécula de agua atrae a otras moléculas de agua debido a las cargas positivas y negativas en las diferentes partes de la molécula. El agua también atrae otras moléculas polares (como los azúcares), formando enlaces de hidrógeno. Cuando una sustancia forma fácilmente enlaces de hidrógeno con agua, se puede disolver en agua y se conoce como hidrofílica ("amante del agua"). Los enlaces de hidrógeno no se forman fácilmente con sustancias no polares como aceites y grasas. Estos compuestos no polares son hidrófobos ("temerosos del agua") y no se disuelven en agua.
| Como muestra esta imagen macroscópica de petróleo y agua, el petróleo es un compuesto no polar y, por lo tanto, no se disolverá en agua. El aceite y el agua no se mezclan. |
El agua estabiliza la temperatura
Los enlaces de hidrógeno en el agua le permiten absorber y liberar energía térmica más lentamente que muchas otras sustancias. La temperatura es una medida del movimiento (energía cinética) de las moléculas. A medida que aumenta el movimiento, la energía es más alta y, por lo tanto, la temperatura es más alta. El agua absorbe una gran cantidad de energía antes de que aumente su temperatura. El aumento de la energía interrumpe los enlaces de hidrógeno entre las moléculas de agua. Debido a que estos enlaces pueden crearse e interrumpirse rápidamente, el agua absorbe un aumento en la energía y los cambios de temperatura solo mínimamente. Esto significa que el agua modera los cambios de temperatura dentro de los organismos y en sus entornos. A medida que continúa la entrada de energía, el equilibrio entre la formación de enlaces de hidrógeno y la destrucción oscila hacia el lado de la destrucción. Se rompen más enlaces de los que se forman. Este proceso da como resultado la liberación de moléculas de agua individuales en la superficie del líquido (como un cuerpo de agua, las hojas de una planta o la piel de un organismo) en un proceso llamado evaporación. La evaporación del sudor, que es 90 por ciento de agua, permite el enfriamiento de un organismo, porque romper los enlaces de hidrógeno requiere un aporte de energía y elimina el calor del cuerpo.
Por el contrario, a medida que el movimiento molecular disminuye y las temperaturas caen, hay menos energía para romper los enlaces de hidrógeno entre las moléculas de agua. Estos enlaces permanecen intactos y comienzan a formar una estructura rígida similar a una red (por ejemplo, hielo). Cuando se congela, el hielo es menos denso que el agua líquida (las moléculas están más separadas). Esto significa que el hielo flota en la superficie de un cuerpo de agua. En lagos, estanques y océanos, se formará hielo en la superficie del agua, creando una barrera aislante para proteger la vida animal y vegetal debajo de la congelación en el agua. Si esto no sucediera, las plantas y los animales que viven en el agua se congelarían en un bloque de hielo y no podrían moverse libremente, haciendo que la vida en temperaturas frías sea difícil o imposible.
| (a) La estructura reticular del hielo lo hace menos denso que las moléculas de agua líquida que fluyen libremente. La menor densidad del hielo le permite (b) flotar sobre el agua. |
El agua es un excelente solvente
Como el agua es polar, con ligeras cargas positivas y negativas, los compuestos iónicos y las moléculas polares pueden disolverse fácilmente en ella. El agua es, por lo tanto, lo que se conoce como solvente, una sustancia capaz de disolver otra sustancia. Las partículas cargadas formarán enlaces de hidrógeno con una capa circundante de moléculas de agua. Esto se conoce como una esfera de hidratación y sirve para mantener las partículas separadas o dispersas en el agua. En el caso de la sal de mesa (NaCl) mezclada en agua, los iones de sodio y cloruro se separan o disocian en el agua, y se forman esferas de hidratación alrededor de los iones. Un ion de sodio con carga positiva está rodeado por las cargas parcialmente negativas de los átomos de oxígeno en las moléculas de agua. Un ion cloruro cargado negativamente está rodeado por las cargas parcialmente positivas de los átomos de hidrógeno en las moléculas de agua. Estas esferas de hidratación también se conocen como capas de hidratación. La polaridad de la molécula de agua la convierte en un solvente efectivo y es importante en sus múltiples funciones en los sistemas vivos.
| Cuando la sal de mesa (NaCl) se mezcla en agua, se forman esferas de hidratación alrededor de los iones. |
El agua es cohesiva
¿Alguna vez llenó un vaso de agua hasta la parte superior y luego agregó lentamente unas gotas más? Antes de que se desborde, el agua en realidad forma una forma de cúpula sobre el borde del vaso. Esta agua puede permanecer por encima del vidrio debido a la propiedad de cohesión. En cohesión, las moléculas de agua se atraen entre sí (debido a la unión de hidrógeno), manteniendo las moléculas juntas en la interfaz líquido-aire (gas), aunque no hay más espacio en el vidrio. La cohesión da lugar a la tensión superficial, la capacidad de una sustancia para resistir la ruptura cuando se coloca bajo tensión o estrés. Cuando deja caer un pequeño trozo de papel sobre una gota de agua, el papel flota sobre la gota de agua, aunque el objeto es más denso (más pesado) que el agua. Esto ocurre debido a la tensión superficial que crean las moléculas de agua. La cohesión y la tensión superficial mantienen intactas las moléculas de agua y el elemento flotando en la parte superior. Incluso es posible "flotar" una aguja de acero sobre un vaso de agua si la coloca suavemente, sin romper la tensión superficial.
| El peso de una aguja sobre el agua tira de la tensión superficial hacia abajo; Al mismo tiempo, la tensión superficial del agua lo empuja hacia arriba, suspende la aguja en la superficie del agua y evita que se hunda. Observe la sangría en el agua alrededor de la aguja. |
Estas fuerzas cohesivas también están relacionadas con la propiedad de adhesión del agua, o la atracción entre las moléculas de agua y otras moléculas. Esto se observa cuando el agua "trepa" por una pajita colocada en un vaso de agua. Notarás que el agua parece ser más alta en los lados de la pajita que en el medio. Esto se debe a que las moléculas de agua son atraídas por la paja y, por lo tanto, se adhieren a ella.
Las fuerzas cohesivas y adhesivas son importantes para mantener la vida. Por ejemplo, debido a estas fuerzas, el agua puede fluir desde las raíces hasta la parte superior de las plantas para alimentarla.
Tampones, pH, ácidos y bases
El pH de una solución es una medida de su acidez o bascicidad. Probablemente ha usado papel tornasol, papel que ha sido tratado con un tinte soluble en agua natural para que pueda usarse como un indicador de pH, para probar cuánto ácido o base (basicidad) existe en una solución. Es posible que incluso haya utilizado algunos para asegurarse de que el agua de una piscina al aire libre se trate adecuadamente. En ambos casos, esta prueba de pH mide la cantidad de iones de hidrógeno que existe en una solución dada. Las altas concentraciones de iones de hidrógeno producen un pH bajo, mientras que bajos niveles de iones de hidrógeno dan como resultado un pH alto. La concentración general de iones de hidrógeno está inversamente relacionada con su pH y puede medirse en la escala de pH. Por lo tanto, cuantos más iones hidrógeno estén presentes, menor será el pH; por el contrario, cuantos menos iones de hidrógeno, mayor es el pH.
La escala de pH varía de 0 a 14. Un cambio de una unidad en la escala de pH representa un cambio en la concentración de iones de hidrógeno por un factor de 10, un cambio en dos unidades representa un cambio en la concentración de iones de hidrógeno por un factor de 100. Por lo tanto, pequeños cambios en el pH representan grandes cambios en las concentraciones de iones de hidrógeno. El agua pura es neutral. No es ácido ni básico, y tiene un pH de 7.0. Cualquier cosa por debajo de 7.0 (que varía de 0.0 a 6.9) es ácida, y cualquier cosa por encima de 7.0 (de 7.1 a 14.0) es alcalina. La sangre en sus venas es ligeramente alcalina (pH = 7.4). El ambiente en su estómago es altamente ácido (pH = 1 a 2). El jugo de naranja es ligeramente ácido (pH = aproximadamente 3.5), mientras que el bicarbonato de sodio es básico (pH = 9.0).
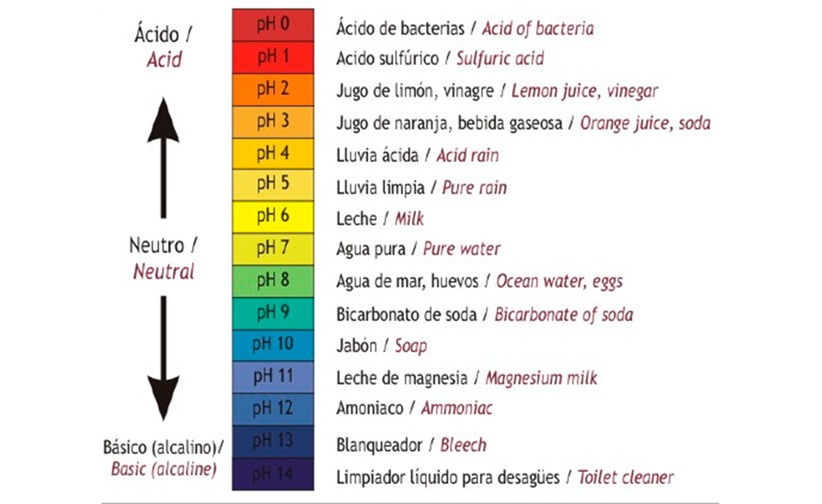 |
| La escala de pH mide la cantidad de iones de hidrógeno (H +) en una sustancia. |
Los ácidos son sustancias que proporcionan iones de
hidrógeno (H+) y un pH más bajo, mientras que las bases proporcionan
iones de hidróxido (OH–) y aumentan el pH. Cuanto más fuerte es el
ácido, más fácilmente dona H+. Por ejemplo, el ácido clorhídrico y
el jugo de limón son muy ácidos y fácilmente abandonan H + cuando se agregan al
agua. Por el contrario, las bases son aquellas sustancias que donan fácilmente
OH–. Los iones OH– se combinan con H+ para
producir agua, lo que eleva el pH de una sustancia. El hidróxido de sodio y
muchos productos de limpieza domésticos son muy alcalinos y abandonan el OH
rápidamente cuando se colocan en agua, elevando así el pH.
La mayoría de las células en nuestros cuerpos operan dentro
de una ventana muy estrecha de la escala de pH, que típicamente varía de 7.2 a
7.6. Si el pH del cuerpo está fuera de este rango, el sistema respiratorio
funciona mal, al igual que otros órganos del cuerpo. Las células ya no
funcionan correctamente y las proteínas se descomponen. La desviación fuera del
rango de pH puede inducir coma o incluso causar la muerte.
Entonces, ¿cómo es que podemos ingerir o inhalar sustancias
ácidas o básicas y no morir? Los amortiguadores son la clave. Los tampones absorben
fácilmente el exceso de H+ u OH–, manteniendo el pH del
cuerpo cuidadosamente mantenido en el rango estrecho antes mencionado. El
dióxido de carbono es parte de un sistema de amortiguación prominente en el
cuerpo humano; Mantiene el pH dentro del rango adecuado. Este sistema de
amortiguación involucra el ácido carbónico (H2CO3) y el
anión bicarbonato (HCO3–). Si entra demasiado H + en el cuerpo, el
bicarbonato se combinará con el H+ para crear ácido carbónico y
limitar la disminución del pH. Del mismo modo, si se introduce demasiado OH–
en el sistema, el ácido carbónico se disociará rápidamente en bicarbonato e
iones H+. Los iones H+ pueden combinarse con los iones OH–,
lo que limita el aumento del pH. Si bien el ácido carbónico es un producto
importante en esta reacción, su presencia es fugaz porque el ácido carbónico se
libera del cuerpo como gas de dióxido de carbono cada vez que respiramos. Sin
este sistema tampón, el pH en nuestros cuerpos fluctuaría demasiado y no
podríamos sobrevivir.
¿Te sirvió el contenido del tema? ¿tienes alguna duda o sugerencia?
Puedes escribir un comentario en la parte de abajo y nosotros con gusto te responderemos. Esperemos que tengas un lindo día. ¡Mucho éxito en tus estudios!
Puedes escribir un comentario en la parte de abajo y nosotros con gusto te responderemos. Esperemos que tengas un lindo día. ¡Mucho éxito en tus estudios!
