Vías metabólicas
Considera el metabolismo del azúcar. Este es un ejemplo
clásico de uno de los muchos procesos celulares que usan y producen energía.
Los seres vivos consumen azúcares como fuente principal de energía, porque las
moléculas de azúcar tienen una gran cantidad de energía almacenada dentro de
sus enlaces. En su mayor parte, los organismos fotosintéticos como las plantas
producen estos azúcares. Durante la fotosíntesis, las plantas usan energía
(originalmente de la luz solar) para convertir el dióxido de carbono (CO2)
en moléculas de azúcar (como la glucosa: C6H12O6).
Consumen dióxido de carbono y producen oxígeno como producto de desecho. Esta
reacción se resume como:
Debido a que este proceso implica sintetizar una molécula de almacenamiento de energía, requiere un aporte de energía para proceder. Durante las reacciones a la luz de la fotosíntesis, la energía es provista por una molécula llamada adenosina trifosfato (ATP), que es la moneda de energía primaria de todas las células. Así como el dólar se usa como moneda para comprar bienes, las células usan moléculas de ATP como moneda de energía para realizar un trabajo inmediato. En contraste, las moléculas de almacenamiento de energía, como la glucosa, se consumen solo para descomponerse para usar su energía. La reacción inversa a la fotosíntesis puede resumir la reacción que recolecta la energía de una molécula de azúcar en las células que requieren oxígeno para sobrevivir. En esta reacción, se consume oxígeno y se libera dióxido de carbono como producto de desecho. La reacción se resume como:
Los procesos de fabricación y descomposición de las moléculas de azúcar ilustran dos ejemplos de vías metabólicas. Una vía metabólica es una serie de reacciones químicas que toma una molécula de partida y la modifica, paso a paso, a través de una serie de intermedios metabólicos, y finalmente produce un producto final. En el ejemplo del metabolismo del azúcar, la primera vía metabólica sintetizó el azúcar a partir de moléculas más pequeñas, y la otra vía descompuso el azúcar en moléculas más pequeñas. Estos dos procesos opuestos, el primero que requiere energía y el segundo que produce energía, se denominan vías anabólicas (polímeros de construcción) y vías catabólicas (descomponen los polímeros en sus monómeros), respectivamente. En consecuencia, el metabolismo se compone de síntesis (anabolismo) y degradación (catabolismo).
Es importante saber que las reacciones químicas de las vías metabólicas no tienen lugar por sí mismas. Cada paso de reacción es facilitado, o catalizado, por una proteína llamada enzima. Las enzimas son importantes para catalizar todo tipo de reacciones biológicas, tanto las que requieren energía como las que liberan energía.
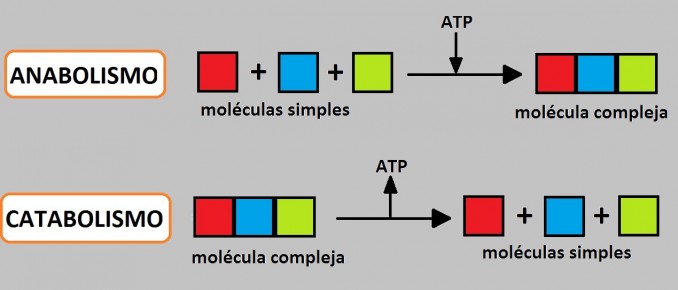 |
| Las vías catabólicas son aquellas que generan energía al descomponer moléculas más grandes. Las vías anabólicas son aquellas que requieren energía para sintetizar moléculas más grandes. Se requieren ambos tipos de vías para mantener el equilibrio energético de la célula. |
Energía
La termodinámica se refiere al estudio de la energía y la transferencia de energía que involucra materia física. El asunto relevante para un caso particular de transferencia de energía se llama sistema, y todo lo que está fuera de ese asunto se llama entorno. Por ejemplo, al calentar una olla de agua en la estufa, el sistema incluye la estufa, la olla y el agua. La energía se transfiere dentro del sistema (entre la estufa, la olla y el agua). Hay dos tipos de sistemas: abiertos y cerrados. En un sistema abierto, la energía puede intercambiarse con su entorno. El sistema de la estufa está abierto porque el calor puede perderse en el aire. Un sistema cerrado no puede intercambiar energía con su entorno.
Los organismos biológicos son sistemas abiertos. La energía se intercambia entre ellos y sus alrededores a medida que usan la energía del sol para realizar la fotosíntesis o consumir moléculas que almacenan energía y liberan energía al medio ambiente haciendo trabajo y liberando calor. Como todas las cosas en el mundo físico, la energía está sujeta a leyes físicas. Las leyes de la termodinámica gobiernan la transferencia de energía en y entre todos los sistemas del universo.
En general, la energía se define como la capacidad de hacer un trabajo o crear algún tipo de cambio. La energía existe en diferentes formas. Por ejemplo, la energía eléctrica, la energía luminosa y la energía térmica son todos tipos diferentes de energía. Para apreciar la forma en que la energía fluye dentro y fuera de los sistemas biológicos, es importante comprender dos de las leyes físicas que rigen la energía.
Termodinámica
La primera ley de la termodinámica establece que la cantidad total de energía en el universo es constante y conservada. En otras palabras, siempre ha habido, y siempre habrá, exactamente la misma cantidad de energía en el universo. La energía existe en muchas formas diferentes. Según la primera ley de la termodinámica, la energía puede transferirse de un lugar a otro o transformarse en diferentes formas, pero no puede crearse ni destruirse. Las transferencias y transformaciones de energía tienen lugar a nuestro alrededor todo el tiempo. Las bombillas transforman la energía eléctrica en luz y energía térmica. Las estufas de gas transforman la energía química del gas natural en energía térmica. Las plantas realizan una de las transformaciones de energía más útiles biológicamente en la tierra: la de convertir la energía de la luz solar en energía química almacenada dentro de las moléculas orgánicas.
El desafío para todos los organismos vivos es obtener energía de su entorno en formas que puedan transferir o transformar en energía utilizable para hacer el trabajo. Las células vivas han evolucionado para enfrentar este desafío. La energía química almacenada dentro de las moléculas orgánicas como los azúcares y las grasas se transfiere y transforma a través de una serie de reacciones químicas celulares en energía dentro de las moléculas de ATP. La energía en las moléculas de ATP es fácilmente accesible para hacer el trabajo. Los ejemplos de los tipos de trabajo que las células necesitan hacer incluyen la construcción de moléculas complejas, el transporte de materiales, el impulso del movimiento de los cilios o flagelos y la contracción de las fibras musculares para crear movimiento.
| Se muestran algunos ejemplos de energía transferida y transformada de un sistema a otro y de una forma a otra. Los alimentos que consumimos proporcionan a nuestras células la energía necesaria para llevar a cabo funciones corporales, así como la energía de la luz proporciona a las plantas los medios para crear la energía química que necesitan. |
Las tareas principales de una célula viva de obtener, transformar y usar energía para hacer el trabajo pueden parecer simples. Sin embargo, la segunda ley de la termodinámica explica por qué estas tareas son más difíciles de lo que parecen. Todas las transferencias y transformaciones de energía nunca son completamente eficientes. En cada transferencia de energía, se pierde una cierta cantidad de energía en una forma que no se puede utilizar. En la mayoría de los casos, esta forma es energía térmica. Termodinámicamente, la energía térmica se define como la energía transferida de un sistema a otro que no funciona. Por ejemplo, cuando se enciende una bombilla, parte de la energía que se convierte de energía eléctrica en energía luminosa se pierde como energía térmica. Del mismo modo, parte de la energía se pierde como energía térmica durante las reacciones metabólicas celulares.
Un concepto importante en los sistemas físicos es el de orden y desorden. Cuanta más energía pierde un sistema en su entorno, menos ordenado y más aleatorio es el sistema. Los científicos se refieren a la medida de aleatoriedad o desorden dentro de un sistema como entropía. Alta entropía significa alto desorden y baja energía. Las moléculas y las reacciones químicas también tienen entropía variable. Por ejemplo, la entropía aumenta a medida que las moléculas a una alta concentración en un lugar se difunden y se extienden. La segunda ley de la termodinámica dice que la energía siempre se perderá como calor en las transferencias o transformaciones de energía.
Los seres vivos están altamente ordenados y requieren un aporte constante de energía para mantenerse en un estado de baja entropía.
Energía potencial y cinética
Cuando un objeto está en movimiento, hay energía asociada con ese objeto. Piensa en una bola de demolición. Incluso una bola de demolición lenta puede causar mucho daño a otros objetos. La energía asociada con los objetos en movimiento se llama energía cinética. Una bala que acelera, una persona que camina y el rápido movimiento de moléculas en el aire (que produce calor) tienen energía cinética.
¿Y si esa misma bola de demolición inmóvil se eleva dos pisos sobre el suelo con una grúa? Si la bola de demolición suspendida no se mueve, ¿hay energía asociada con ella? La respuesta es sí. La energía que se requería para levantar la bola de demolición no desapareció, pero ahora se almacena en la bola de demolición en virtud de su posición y la fuerza de gravedad que actúa sobre ella. Este tipo de energía se llama energía potencial. Si la bola cayera, la energía potencial se transformaría en energía cinética hasta que toda la energía potencial se agotara cuando la bola descansara en el suelo. Las bolas de demolición también se balancean como un péndulo; a través del columpio, hay un cambio constante de energía potencial (más alta en la parte superior del columpio) a energía cinética (más alta en la parte inferior del columpio). Otros ejemplos de energía potencial incluyen la energía del agua retenida detrás de una presa o una persona a punto de saltar en paracaídas desde un avión.
| Todavía el agua tiene energía potencial; El agua en movimiento, como en una cascada o en un río que fluye rápidamente, tiene energía cinética. |
La energía potencial no solo está asociada con la ubicación de la materia, sino también con la estructura de la materia. Incluso un resorte en el suelo tiene energía potencial si está comprimido; también lo hace una banda elástica que se tensa. A nivel molecular, los enlaces que mantienen unidos a los átomos de las moléculas existen en una estructura particular que tiene energía potencial. Recuerde que las vías celulares anabólicas requieren energía para sintetizar moléculas complejas de las más simples y las vías catabólicas liberan energía cuando las moléculas complejas se descomponen. El hecho de que la energía puede ser liberada por la ruptura de ciertos enlaces químicos implica que esos enlaces tienen energía potencial. De hecho, hay energía potencial almacenada dentro de los enlaces de todas las moléculas de alimentos que comemos, que eventualmente se aprovecha para su uso. Esto se debe a que estos enlaces pueden liberar energía cuando se rompen. El tipo de energía potencial que existe dentro de los enlaces químicos, y se libera cuando esos enlaces se rompen, se llama energía química. La energía química es responsable de proporcionar a las células vivas la energía de los alimentos. La liberación de energía ocurre cuando los enlaces moleculares dentro de las moléculas de los alimentos se rompen.
Energía libre y de activación
Después de enterarse de que las reacciones químicas liberan energía cuando se rompen los enlaces de almacenamiento de energía, la siguiente pregunta importante es la siguiente: ¿Cómo se cuantifica y expresa la energía asociada con estas reacciones químicas? ¿Cómo se puede comparar la energía liberada de una reacción con la de otra reacción? Se utiliza una medida de energía libre para cuantificar estas transferencias de energía. Recuerde que de acuerdo con la segunda ley de la termodinámica, todas las transferencias de energía implican la pérdida de cierta cantidad de energía en una forma inutilizable, como el calor. La energía libre se refiere específicamente a la energía asociada con una reacción química que está disponible después de contabilizar las pérdidas. En otras palabras, la energía libre es energía utilizable, o energía que está disponible para hacer el trabajo.
Si se libera energía durante una reacción química, entonces el cambio en la energía libre, significada como ∆G (delta G) será un número negativo. Un cambio negativo en la energía libre también significa que los productos de la reacción tienen menos energía libre que los reactivos, porque liberan algo de energía libre durante la reacción. Las reacciones que tienen un cambio negativo en la energía libre y, en consecuencia, liberan energía libre se denominan reacciones exergónicas. Piensa: exergónico significa que la energía está saliendo del sistema. Estas reacciones también se conocen como reacciones espontáneas, y sus productos tienen menos energía almacenada que los reactivos. Debe hacerse una distinción importante entre el término espontáneo y la idea de una reacción química que ocurre de inmediato. Contrariamente al uso diario del término, una reacción espontánea no es una que ocurre repentina o rápidamente. La oxidación del hierro es un ejemplo de una reacción espontánea que ocurre lentamente, poco a poco, con el tiempo.
Si una reacción química absorbe energía en lugar de liberar energía en equilibrio, entonces el ∆G para esa reacción será un valor positivo. En este caso, los productos tienen más energía libre que los reactivos. Por lo tanto, los productos de estas reacciones pueden considerarse moléculas que almacenan energía. Estas reacciones químicas se llaman reacciones endergónicas y no son espontáneas. Una reacción endergónica no tendrá lugar por sí sola sin la adición de energía libre.
| Se muestran algunos ejemplos de procesos endergónicos (que requieren energía) y procesos exergónicos (que liberan energía). |
Enzimas
Una sustancia que ayuda a que ocurra una reacción química se llama catalizador, y las moléculas que catalizan reacciones bioquímicas se llaman enzimas. La mayoría de las enzimas son proteínas y realizan la tarea crítica de reducir las energías de activación de las reacciones químicas dentro de la célula. La mayoría de las reacciones críticas para una célula viva suceden demasiado lentamente a temperaturas normales para ser de alguna utilidad para la célula. Sin enzimas para acelerar estas reacciones, la vida no podría persistir. Las enzimas hacen esto uniéndose a las moléculas reactivas y manteniéndolas de tal manera que los procesos de ruptura y formación de enlaces químicos se llevan a cabo más fácilmente. Es importante recordar que las enzimas no cambian si una reacción es exergónica (espontánea) o endergónica. Esto se debe a que no cambian la energía libre de los reactivos o productos. Solo reducen la energía de activación requerida para que la reacción avance. Además, una enzima en sí no cambia por la reacción que cataliza. Una vez que se ha catalizado una reacción, la enzima puede participar en otras reacciones.
Los reactivos químicos a los que se une una enzima se llaman sustratos de la enzima. Puede haber uno o más sustratos, dependiendo de la reacción química particular. En algunas reacciones, un solo sustrato reactivo se descompone en múltiples productos. En otros, dos sustratos pueden unirse para crear una molécula más grande. Dos reactivos también pueden entrar en una reacción y ambos se modifican, pero dejan la reacción como dos productos. La ubicación dentro de la enzima donde se une el sustrato se denomina sitio activo de la enzima. El sitio activo es donde ocurre la "acción". Como las enzimas son proteínas, existe una combinación única de cadenas laterales de aminoácidos dentro del sitio activo. Cada cadena lateral se caracteriza por diferentes propiedades. Pueden ser grandes o pequeños, débilmente ácidos o básicos, hidrófilos o hidrófobos, cargados positiva o negativamente, o neutros. La combinación única de cadenas laterales crea un entorno químico muy específico dentro del sitio activo. Este entorno específico es adecuado para unirse a un sustrato químico específico (o sustratos).
Los sitios activos están sujetos a las influencias del entorno local. El aumento de la temperatura ambiental generalmente aumenta las velocidades de reacción, catalizadas por enzimas o de otra manera. Sin embargo, las temperaturas fuera de un rango óptimo reducen la velocidad a la que una enzima cataliza una reacción. Las altas temperaturas eventualmente causarán que las enzimas se desnaturalicen, un cambio irreversible en la forma tridimensional y, por lo tanto, en la función de la enzima. Las enzimas también son adecuadas para funcionar mejor dentro de un cierto rango de pH y concentración de sal, y, al igual que con la temperatura, el pH extremo y las concentraciones de sal pueden causar que las enzimas se desnaturalicen.
Durante muchos años, los científicos pensaron que la unión del sustrato enzimático se realizaba de manera simple "cerradura y llave". Este modelo afirmó que la enzima y el sustrato encajan perfectamente en un solo paso instantáneo. Sin embargo, la investigación actual apoya un modelo llamado ajuste inducido. El modelo de ajuste inducido se expande en el modelo de cerradura y llave al describir una unión más dinámica entre la enzima y el sustrato. A medida que la enzima y el sustrato se unen, su interacción provoca un cambio leve en la estructura de la enzima que forma una disposición de unión ideal entre la enzima y el sustrato.
Cuando una enzima se une a su sustrato, se forma un complejo enzima-sustrato. Este complejo reduce la energía de activación de la reacción y promueve su rápida progresión en una de las múltiples formas posibles. En un nivel básico, las enzimas promueven reacciones químicas que involucran más de un sustrato al unir los sustratos en una orientación óptima para la reacción. Otra forma en que las enzimas promueven la reacción de sus sustratos es creando un ambiente óptimo dentro del sitio activo para que ocurra la reacción. Las propiedades químicas que surgen de la disposición particular de los grupos de aminoácidos R dentro de un sitio activo crean el ambiente perfecto para que reaccionen los sustratos específicos de una enzima.
El complejo enzima-sustrato también puede reducir la energía de activación al comprometer la estructura de enlace para que sea más fácil de romper. Finalmente, las enzimas también pueden reducir las energías de activación al participar en la reacción química misma. En estos casos, es importante recordar que la enzima siempre volverá a su estado original al completarse la reacción. Una de las propiedades distintivas de las enzimas es que permanecen inalteradas en última instancia por las reacciones que catalizan. Después de que una enzima ha catalizado una reacción, libera su (s) producto (s) y puede catalizar una nueva reacción.
 |
| El modelo de ajuste inducido es un ajuste al modelo de bloqueo y llave y explica cómo las enzimas y los sustratos sufren modificaciones dinámicas durante el estado de transición para aumentar la afinidad del sustrato por el sitio activo. |
Parecería ideal tener un escenario en el que todas las enzimas de un organismo existieran en abundancia y funcionaran de manera óptima en todas las condiciones celulares, en todas las células, en todo momento. Sin embargo, una variedad de mecanismos asegura que esto no suceda. Las necesidades y condiciones celulares varían constantemente de una célula a otra, y cambian dentro de las células individuales con el tiempo. Las enzimas requeridas de las células del estómago difieren de las células de almacenamiento de grasa, células de la piel, células sanguíneas y células nerviosas. Además, una célula del órgano digestivo trabaja mucho más duro para procesar y descomponer los nutrientes durante el tiempo que sigue de cerca a una comida en comparación con muchas horas después de una comida. Como estas demandas y condiciones celulares varían, también deben variar las cantidades y la funcionalidad de las diferentes enzimas.
Dado que las velocidades de las reacciones bioquímicas están controladas por la energía de activación, y las enzimas disminuyen y determinan las energías de activación para las reacciones químicas, las cantidades relativas y el funcionamiento de la variedad de enzimas dentro de una célula determinan en última instancia qué reacciones procederán y a qué velocidades. Esta determinación está estrechamente controlada en las células. En ciertos entornos celulares, la actividad enzimática está parcialmente controlada por factores ambientales como el pH, la temperatura, la concentración de sal y, en algunos casos, cofactores o coenzimas.
Las enzimas también se pueden regular de maneras que promueven o reducen la actividad enzimática. Hay muchos tipos de moléculas que inhiben o promueven la función enzimática, y varios mecanismos por los cuales lo hacen. En algunos casos de inhibición enzimática, una molécula inhibidora es lo suficientemente similar a un sustrato que puede unirse al sitio activo y simplemente bloquear la unión del sustrato. Cuando esto sucede, la enzima se inhibe a través de la inhibición competitiva, porque una molécula inhibidora compite con el sustrato para unirse al sitio activo.
Por otro lado, en la inhibición no competitiva, una molécula inhibidora se une a la enzima en un lugar diferente al sitio activo, llamado sitio alostérico, pero aún logra bloquear la unión del sustrato al sitio activo. Algunas moléculas inhibidoras se unen a las enzimas en un lugar donde su unión induce un cambio conformacional que reduce la afinidad de la enzima por su sustrato. Este tipo de inhibición se llama inhibición alostérica. La mayoría de las enzimas reguladas alostéricamente están formadas por más de un polipéptido, lo que significa que tienen más de una subunidad proteica. Cuando un inhibidor alostérico se une a una región en una enzima, todos los sitios activos en las subunidades de proteínas cambian ligeramente de modo que se unen a sus sustratos con menos eficiencia. Hay activadores alostéricos e inhibidores. Los activadores alostéricos se unen a ubicaciones en una enzima alejada del sitio activo, induciendo un cambio conformacional que aumenta la afinidad de los sitios activos de la enzima por sus sustrato (s).
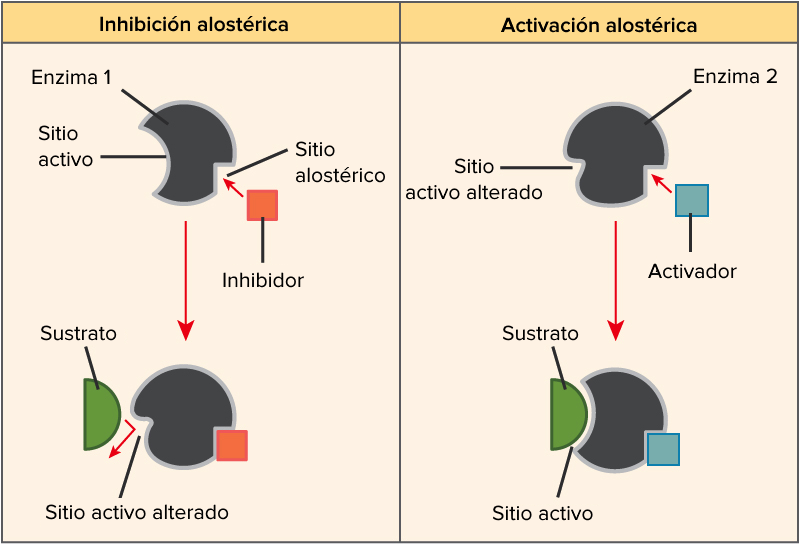 |
| La inhibición alostérica funciona al inducir indirectamente un cambio conformacional en el sitio activo de modo que el sustrato ya no se ajuste. Por el contrario, en la activación alostérica, la molécula activadora modifica la forma del sitio activo para permitir un mejor ajuste del sustrato. |
CONEXIÓN PROFESIONAL: Desarrollador de medicamentos farmacéuticos
| ¿Alguna vez te has preguntado cómo se desarrollan las drogas farmacéuticas? |
Las enzimas son componentes clave de las vías metabólicas. Comprender cómo funcionan las enzimas y cómo se pueden regular son principios clave detrás del desarrollo de muchos de los medicamentos farmacéuticos en el mercado actual. Los biólogos que trabajan en este campo colaboran con otros científicos para diseñar medicamentos.
Considere las estatinas, por ejemplo: estatinas es el nombre dado a una clase de medicamentos que pueden reducir los niveles de colesterol. Estos compuestos son inhibidores de la enzima HMG-CoA reductasa, que es la enzima que sintetiza el colesterol de los lípidos en el cuerpo. Al inhibir esta enzima, se puede reducir el nivel de colesterol sintetizado en el cuerpo. Del mismo modo, el acetaminofeno, popularmente comercializado bajo la marca Tylenol, es un inhibidor de la enzima ciclooxigenasa. Si bien se usa para aliviar la fiebre y la inflamación (dolor), su mecanismo de acción aún no se comprende por completo.
¿Cómo se descubren las drogas? Uno de los mayores desafíos en el descubrimiento de fármacos es identificar un objetivo farmacológico. Un objetivo farmacológico es una molécula que es literalmente el objetivo del fármaco. En el caso de las estatinas, la HMG-CoA reductasa es el objetivo farmacológico. Los objetivos farmacológicos se identifican a través de una minuciosa investigación en el laboratorio. Identificar el objetivo solo no es suficiente; Los científicos también necesitan saber cómo actúa el objetivo dentro de la célula y qué reacciones salen mal en caso de enfermedad. Una vez que se identifican el objetivo y la vía, comienza el proceso real de diseño del medicamento. En esta etapa, los químicos y los biólogos trabajan juntos para diseñar y sintetizar moléculas que pueden bloquear o activar una reacción particular. Sin embargo, esto es solo el comienzo: si y cuando un prototipo de fármaco tiene éxito en el desempeño de su función, se lo somete a muchas pruebas desde experimentos in vitro hasta ensayos clínicos antes de que pueda obtener la aprobación de la Administración de Alimentos y Medicamentos de EE. UU. El mercado.
Muchas enzimas no funcionan de manera óptima, o incluso en absoluto, a menos que se unan a otras moléculas auxiliares no proteicas específicas. Pueden unirse temporalmente a través de enlaces iónicos o de hidrógeno, o permanentemente a través de enlaces covalentes más fuertes. La unión a estas moléculas promueve la forma y función óptimas de sus enzimas respectivas. Dos ejemplos de estos tipos de moléculas auxiliares son cofactores y coenzimas. Los cofactores son iones inorgánicos como los iones de hierro y magnesio. Las coenzimas son moléculas auxiliares orgánicas, aquellas con una estructura atómica básica compuesta de carbono e hidrógeno. Al igual que las enzimas, estas moléculas participan en reacciones sin ser cambiadas y, en última instancia, se reciclan y reutilizan. Las vitaminas son la fuente de las coenzimas. Algunas vitaminas son las precursoras de las coenzimas y otras actúan directamente como coenzimas. La vitamina C es una coenzima directa para múltiples enzimas que participan en la construcción del importante tejido conectivo, el colágeno. Por lo tanto, la función enzimática está, en parte, regulada por la abundancia de varios cofactores y coenzimas, que pueden ser suministrados por la dieta de un organismo o, en algunos casos, producidos por el organismo.
Inhibición de retroalimentación en vías metabólicas
Las moléculas pueden regular la función enzimática de muchas maneras. Sin embargo, la pregunta principal sigue siendo: ¿qué son estas moléculas y de dónde provienen? Algunos son cofactores y coenzimas, como has aprendido. ¿Qué otras moléculas en la célula proporcionan regulación enzimática, como la modulación alostérica y la inhibición competitiva y no competitiva? Quizás las fuentes más relevantes de moléculas reguladoras, con respecto al metabolismo celular enzimático, son los productos de las propias reacciones metabólicas celulares. De la manera más eficiente y elegante, las células han evolucionado para usar los productos de sus propias reacciones para la inhibición por retroalimentación de la actividad enzimática. La inhibición por retroalimentación implica el uso de un producto de reacción para regular su propia producción adicional. La célula responde a la abundancia de los productos al ralentizar la producción durante las reacciones anabólicas o catabólicas. Dichos productos de reacción pueden inhibir las enzimas que catalizan su producción a través de los mecanismos descritos anteriormente.
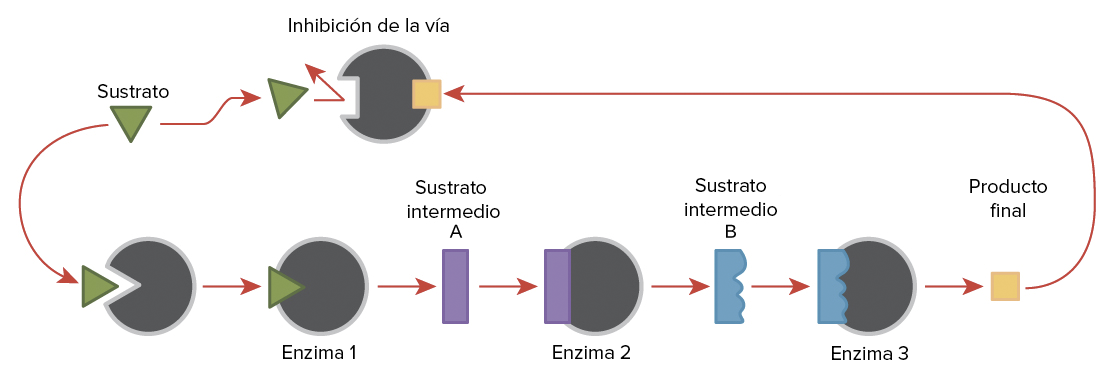 |
| Las vías metabólicas son una serie de reacciones catalizadas por múltiples enzimas. La inhibición de la retroalimentación, donde el producto final de la vía inhibe un proceso aguas arriba, es un mecanismo regulador importante en las células. |
¿Te sirvió el contenido del tema? ¿tienes alguna duda o sugerencia?
Puedes escribir un comentario en la parte de abajo y nosotros con gusto te responderemos. Esperemos que tengas un lindo día. ¡Mucho éxito en tus estudios!
Puedes escribir un comentario en la parte de abajo y nosotros con gusto te responderemos. Esperemos que tengas un lindo día. ¡Mucho éxito en tus estudios!
